Pomozte vývoji webu a sdílení článku s přáteli!
Co je uvnitř? Tuto otázku si položil každý. To je jedna z charakteristik přirozené lidské zvědavosti.
Tuto zvědavost uspokojujeme od dětství. Čím déle si tuto otázku budeme moci klást (a jiní mají rádi), nejlépe až do stáří, tím bohatší bude náš život.
Ale na co se vlastně ptáme? Dítě při pohledu dovnitř hračky nejprve hledá nějakou novou strukturu materiálu. Mladý muž, který se dívá do knihy nebo internetu, hledá především informace – méně ho zajímá, z čeho jsou vyrobeny.Archeolog zkoumající nově vykopanou historickou budovu hledá informace i materiálovou strukturu – ta bude také převedena na informaci. Stejně tak geolog, hledící (kladíkem a dlátem, lupou, rentgenem) do hlubin skály, hledá tam minerály a symetrii a krásu.
Je nutné změnit vnější strukturu nebo dokonce zničit to, co chceme vidět uvnitř? Naštěstí ne! Do nitra lidského těla se totiž lékař dívá pomocí celého arzenálu nástrojů a nástrojů. Moderní medicíny si ceníme pro její minimálně invazivní nebo téměř neinvazivní průnik. Není nutné nahlížet dovnitř pomocí lidských smyslů - vidíme pomocí ultrazvuku, rentgenu, rádiových vln a mnoha dalších metod.
Jsme vždy připraveni na to, že se musíme podívat dovnitř? Samozřejmě, že ne, zvažte například pohled do zatuchlého vejce. Alchymisté často považovali jejich směsi s ohněm - někdy explodoval, protože uvnitř byla kromě struktury a informací uložena energie.Pohled dovnitř atomového jádra dokonce umožnil předpovědět, i když ne okamžitě, že „z toho bude energie.“
Teorie - stručná a jasná
Na konci prvního desetiletí 20. století se Ernst Rutherford spolu se svými kolegy Hansem Geigerem a Ernestem Marsdenem podíval do nitra atomu. Předmět, jehož existence o století dříve nebyla ničím jiným než hypotézou, kuriozitou zděděnou od Démokrita a některých dalších starověkých myslitelů. Objekt, o kterém se ještě v polovině 19. století předpokládalo, že uvnitř nic není. Objekt, který se nakonec stal tak malým, že ho nebylo možné vidět – vědělo se jen, že atomy spíše existují. Jak vypadaly uvnitř atomu? co hledali? co viděli? Bylo to to, co očekávali, nebo něco úplně jiného? Rozhodně stojí za to si o tom všem přečíst
 Rýže. 1. (Zleva doprava) Ernest Rutherford, Hans Geiger a Ernest Marsden navrhli a provedli řadu experimentů v letech 1908 až 1911, ve kterých studovali rozložení hmoty v atomu. Po interpretaci výsledků vyvinuli planetární model atomu.
Rýže. 1. (Zleva doprava) Ernest Rutherford, Hans Geiger a Ernest Marsden navrhli a provedli řadu experimentů v letech 1908 až 1911, ve kterých studovali rozložení hmoty v atomu. Po interpretaci výsledků vyvinuli planetární model atomu.
Devatenácté století přineslo mnoho vědeckých výzkumů na hranici mezi chemií a fyzikou. To zahrnovalo výzkum problému „prvek versus sloučenina“, kvantitativního aspektu chemických reakcí, včetně jevu elektrolýzy, a také v oblasti termodynamiky a optiky. Objevil se koncept Avogadrova čísla.
Objasnění chování látky v těkavém stavu bylo velkým úspěchem kineticko-molekulární teorie. Předpokládala zrnitou strukturu hmoty, tedy existenci nejmenších částic hmoty: atomů nebo jejich přesně definovaných skupin – molekul. Toto je nejčastěji uváděný příklad; na základě podobných předpokladů je vysvětleno i mnoho dalších jevů. Studium hmoty v pevném skupenství zase umožnilo odhadnout velikost jednotlivých atomů (obr. 2).
Ukázalo se, že bez ohledu na prvek byly tyto rozměry řádově jeden nebo dva angstromy. Podařilo se nám odhadnout i hmotnosti různých atomů – ukázalo se, že souvisí s hmotnostním číslem A prvku. Bylo známo, že atomy jsou elektricky neutrální.
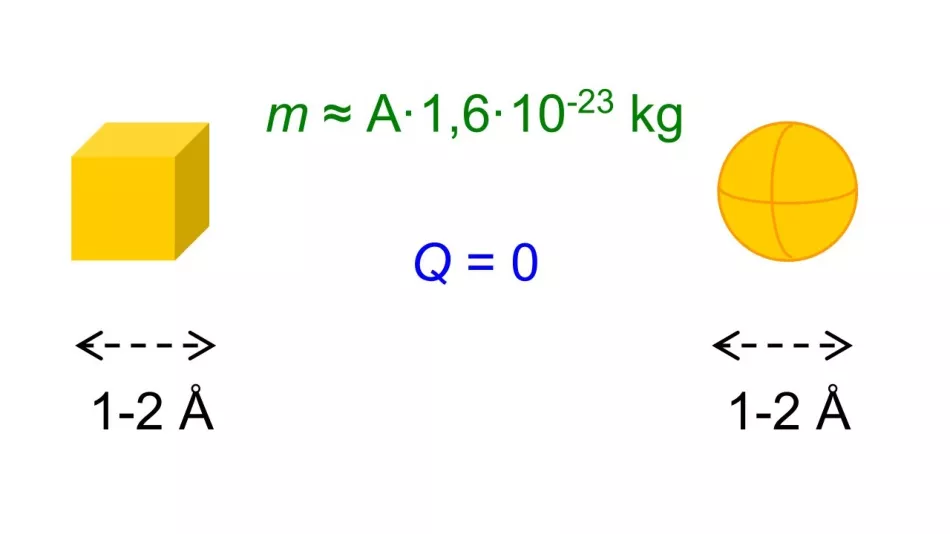 Rýže. 2. Ať už byly atomy reprezentovány jako koule, krychle nebo jiné tvary, byly známy jejich přibližné rozměry, atomové číslo Z a hmotnostní číslo A a také byla známa jejich elektrická setrvačnost.
Rýže. 2. Ať už byly atomy reprezentovány jako koule, krychle nebo jiné tvary, byly známy jejich přibližné rozměry, atomové číslo Z a hmotnostní číslo A a také byla známa jejich elektrická setrvačnost.
Co je uvnitř atomu?
Nečekaným výsledkem tohoto výzkumu byl objev vnitřní struktury atomů. Katodové paprsky, známé již několik desetiletí, byly rozpoznány v prvním desetiletí 20. století jako svazky „atomů elektřiny“ (dnes známe: elektrony) s vlastnostmi nezávislými na materiálu, ze kterého jsou emitovány. Existuje pouze jeden závěr: elektrony jsou součástí každého atomu. Nicméně jak jejich nenulový elektrický náboj (dnes známe záporný), tak jejich tehdy známá hmotnost (o tři až čtyři řády menší než hmotnost atomu) naznačovaly, že atomy musí mít ještě nějaké složky (obr. 3).
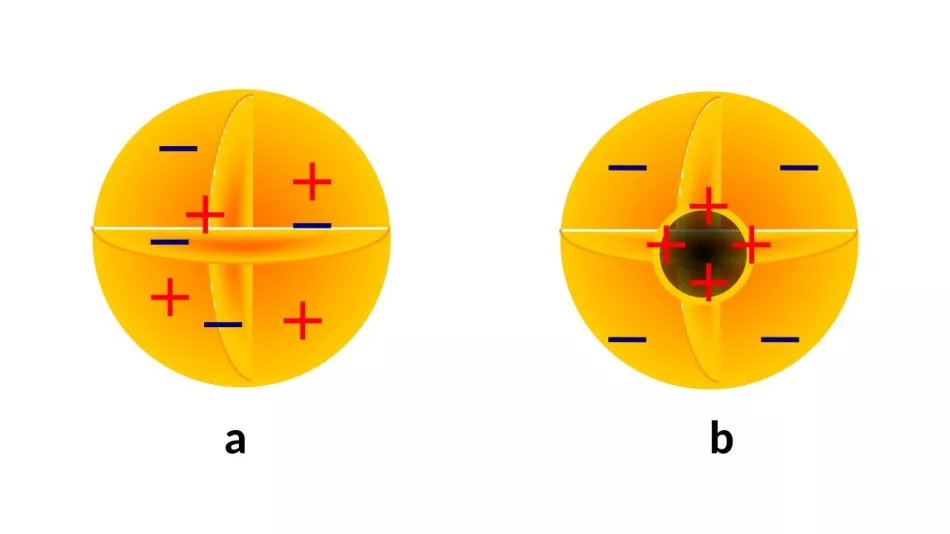 Na přelomu 20. a 20. století bylo vyvinuto několik modelů k popisu prostorového rozložení hmoty a náboje. Někteří (obr. 2a) předpovídali rovnoměrné rozložení hmoty a náboje uvnitř atomu.
Na přelomu 20. a 20. století bylo vyvinuto několik modelů k popisu prostorového rozložení hmoty a náboje. Někteří (obr. 2a) předpovídali rovnoměrné rozložení hmoty a náboje uvnitř atomu.Převládal však názor existence atomového jádra (obr. 2b) - kladně nabité, masivní vnitřní podstruktury, s které elektrony jsou spojeny tak či onak, ne nutně symetricky.
Problém byl o tom, jak jsou složky uspořádány uvnitř atomu, včetně povahy jejich možného pohybu. Byly předloženy různé hypotézy, i když převládající názor byl, že:
- hmotnost atomu souvisí s tím, co je v něm kladně nabité (Rutherford tomu říkal atomové jádro);
- tato hmota je víceméně rovnoměrně rozložena v oblasti, jejíž velikost je o řád menší než velikost atomu, možná o dva, tzn. od 0,01Å do 0,1Å;
- V atomu nesmí být žádný prázdný prostor, jinak se atomová hmota nebrání pohybu - elektronový paprsek, podobně jako rentgenový paprsek, volně prochází poměrně tenkými oblastmi hmoty, například kovovými fóliemi a několik mikronů tlusté.
Jak se podívat dovnitř atomu?
Každý dnešní fyzik vám řekne, že je to snadné. Vše, co je potřeba, je nasměrovat vhodné částice na atom, působící jako náboje, a studovat účinky interakce těchto nábojů se složkami atomu. Aby se zabránilo vlivu interakce s elektrony, náboje musí mít hmotnost mnohem větší než hmotnost elektronů. Ale také musí mít hmotnost menší, než je hmotnost toho, co chceme v atomu studovat.
Aby nedošlo k nestabilnímu výsledku, musí mít náboje také dostatečně vysokou energii. V Rutherfordově době nebyly žádné urychlovače, takže výběr nábojů byl malý: částice α, které objevil o deset let dříve, těmto podmínkám docela vyhovovaly. Cílem (fyzici někdy používají termín „screen“) pro α-částice byly atomy zlata v tenké fólii. Rutherford a jeho kolegové studovali jiné kovy, ale zlato, kujný a tažný kov, umožnilo vytvoření filmu o tloušťce až půl mikrometru (0,510-6 m).
Naměřeným účinkem interakce s atomem zlata byl úhel rozptylu částic α (obr. 3.).
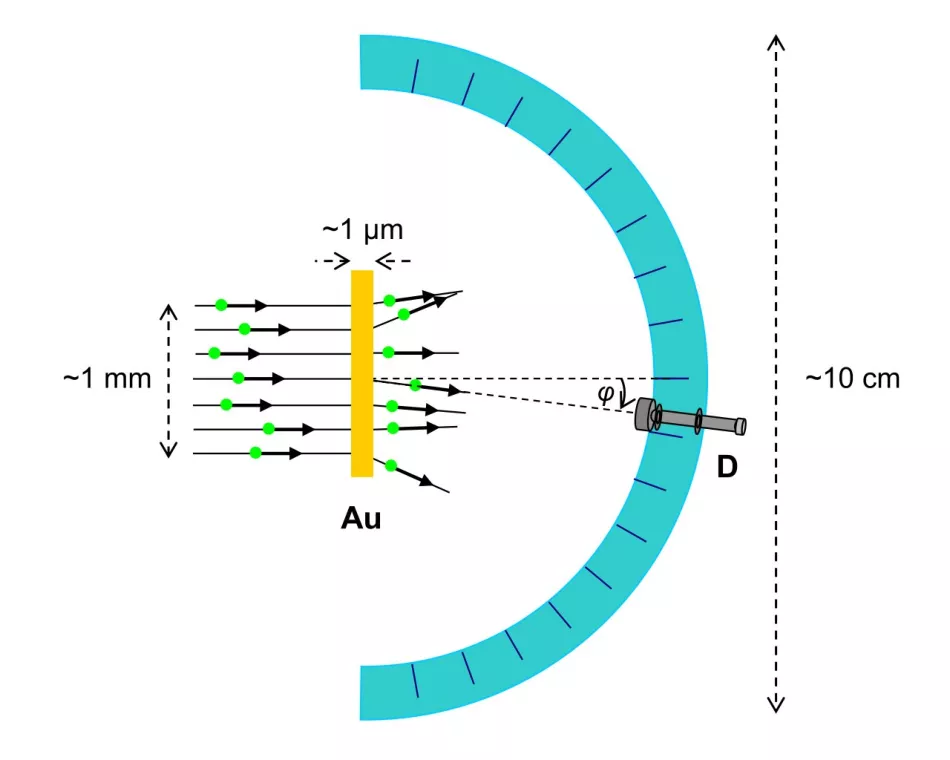 Rýže. 3. Schéma Rutherfordova experimentu (pohled shora)
Rýže. 3. Schéma Rutherfordova experimentu (pohled shora)
α-částice přicházejí ve formě paprsku širokého asi milimetr a jsou rozptýleny v kovové fólii o tloušťce asi mikronu. Detektor α-částic je umístěn v sérii, v různých úhlech k počátečnímu směru paprsku, na půlkruhovém vedení o velikosti asi decimetru.
Experimentátor se podívá do okuláru a spočítá počet záblesků způsobených částicemi α rozptýlenými v daném úhlu během stanovené doby. Referenční čas je stejný pro všechny úhly.
Úhel rozptylu závisí na několika faktorech:
- pro kinetickou energii Ek částice α,
- nabito, qa=+2e,
- na náboji jádra (zlato nebo jakýkoli jiný prvek použitý v experimentu), tzn. z atomového čísla Z tohoto prvku: Q=+Ze,
- z odhadovaného poloměru atomového jádra Rj,
- na parametr dopadu b částice α s jádrem.
Co se očekávalo?
Rutherford et al studovali, jak často dochází k rozptylu pod určitým úhlem φ k původnímu směru letu. V souladu s tehdejšími představami o velikosti atomového jádra očekávali, že tyto úhly budou v omezeném, relativně malém rozsahu. Maximální hodnota φmúhlu rozptylu závisí na odhadovaném poloměru rja je dosažena pro každou z jeho hodnot při různých hodnotách parametru dopadu bmObrázek 4 ukazuje dráhu 1 MeV alfa částice rozptýlené pod maximálním úhlem, za předpokladu Rj=0,01 Å. Stalo se, že α-částice pak projde malou vrstvou jádra.
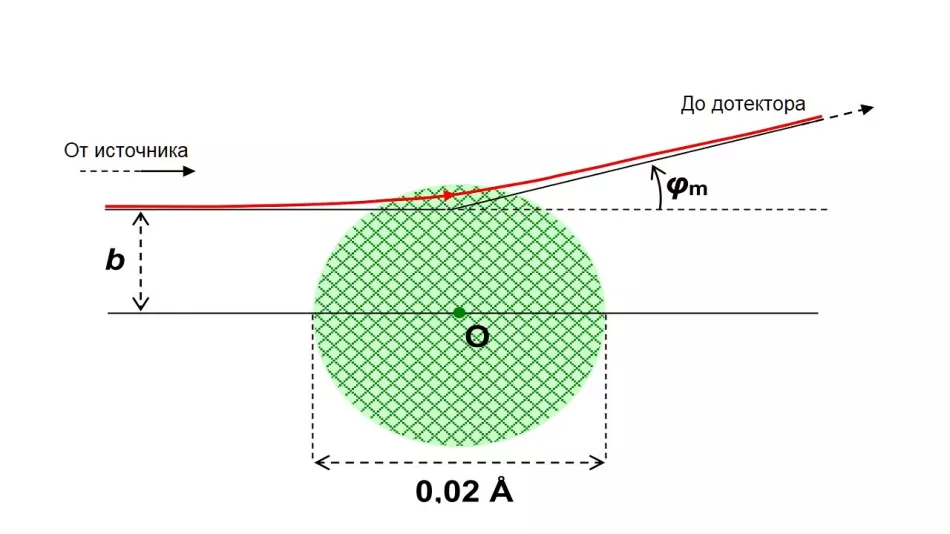 Rýže. 4. Stopa α-částice s Ек=1 MeV, rozptýlená při interakci s jádrem atomu zlata.
Rýže. 4. Stopa α-částice s Ек=1 MeV, rozptýlená při interakci s jádrem atomu zlata.
Byl přijat hypotetický poloměr jádra Rj=0,01 Å (10-12 m). To je o více než dva řády větší než skutečný poloměr jádra atomu zlata. Na tomto obrázku bude menší než tečka, která označuje střed atomu.
Parametr zaměřování b ≈ 8-10-13m poskytuje maximální úhel rozptylu φm ≈ 15°.
α částice padající s parametry většími než bma obcházejíc hypotetické jádro se vždy rozptylují pod menším úhlem - letí dále od středu kladného náboje a méně se odchylují. Totéž platí pro částice padající blíže k centrálnímu směru (b
Výsledky výpočtu úhlů φmpro několik hodnot poloměru atomového jádra, provedené v souladu se znalostí atomové struktury z počátku 20. století jsou uvedeny v tabulce 1.Stojí za to připomenout, že v té době nebyly brány v úvahu hodnoty Rj pro atomové jádro menší než 0,01 Å.
| Poloměr atomového jádra Rj | Maximální úhel paprsku φm | Maximální úhel s parametrem zaměřování |
| 0,1 Å | 1,4° | 0,09 Å |
| 0,05 Å | 2,7° | 0,046 Å |
| 0,01 Å | 15° | 0,008 Å |
| 0,005 Å | 37° | 0,003 Å |
Závěr: znalost času nám umožnila získat maximální úhly rozptylu několik stupňů.
Kognitivní šok experimentátora
Podle očekávání se ukázalo, že naprostá většina α-částic je rozptýlena pod malými úhly, v řádu několika stupňů. Ukázalo se také - zcela proti očekávání - že v některých případech byly částice α rozptýleny pod úhlem více než 90° a dokonce se téměř přesně odrážely zpět! Geiger a Marsden to opakovaně testovali pomocí mírně odlišných experimentálních nastavení, než to oznámili Rutherfordovi. Takový výsledek nikdo nečekal.
Rutherford opakovaně vzpomínal, že byl tímto výsledkem nesmírně ohromen. Během jedné ze svých přednášek na univerzitě v Cambridge pronesl slavná slova, jejichž dramatičnost žádný překlad nedokáže vyjádřit:
Byla to ta nejneuvěřitelnější událost, která se mi kdy v životě stala. Bylo to skoro tak neuvěřitelné, jako kdybyste vystřelili 15palcový granát na kus hedvábného papíru a ten se vrátil a zasáhl vás.
Ernest Rutherford
Pokračování výše uvedeného citátu je odhalující: „Po nějakém přemýšlení jsem dospěl k závěru, že rozptyl v tomto úhlu byl pravděpodobně výsledkem jediné kolize. Provedl jsem odpovídající výpočty; přesvědčili mě, že je možné jen jedno vysvětlení: atom je systém, jehož prakticky celá hmota je soustředěna v mikroskopickém jádru, kladně nabitá.“
Zde je závěr hodný fyzika: když dobře provedený experiment nesouhlasí s předchozími přesvědčeními nebo dokonce zavedenou teorií, zahodíme přesvědčení a přepracujeme teorii.
Rutherfordova interpretace
Použijme tři diagramy zobrazené na obrázcích 5, 6 a 7, abychom viděli, co Rutherford viděl uvnitř atomu. Ve všech diagramech se částice α s energií 1 MeV (to odpovídá rychlosti téměř 7000 km/s) přibližuje k atomu centrálně - srážkový parametr je roven nule. Předpokládáme, že náboj jádra atomu se rovná náboji zlatého jádra - 79 elementárních nábojů.Síla elektrostatického odpuzování jádra je opačná než rychlost částice α.
Předpokládáme, že atom zůstává nehybný, a ptáme se, zda Coulombova síla může zastavit částici α a poslat ji zpět, než projde středem jádra. Pokud ano, pak bude částice α urychlena Coulombovou silou a vrátí se tam, odkud přišla, a její úhel rozptylu bude 180°. Pokud ne, pak naopak částice α poletí dále a úhel rozptylu bude roven nule. Ukazuje se, že rozhodující je zde velikost atomového jádra.
Rj=0,1 Å, tzn. jádro je 10x menší než atom
Obrázek 5 ukazuje situaci v měřítku celého atomu, jehož poloměr je 1 Å. Poloměr jádra je Rj=0,1 Å. Horní graf ukazuje závislost Coulombovy síly na vzdálenosti od středu jádra. Tato síla dosahuje maximální hodnoty těsně pod 0,4 mN, když částice α vstoupí do jádra. Počínaje tímto bodem se Coulombova síla lineárně snižuje a ve středu jádra dosahuje nuly.
Závislost rychlosti částice α na stejné vzdálenosti je vykreslena ve spodní části diagramu. Tato rychlost klesá, jak se člověk přibližuje k okraji jádra. Po vstupu do oblasti jádra je tento pokles méně výrazný – to odpovídá poklesu hodnoty Coulombovy síly. Celkově se rychlost snížila o necelá 2 %. Po průchodu středem jádra se α-částice zrychlí, což způsobí, že opustí jádro a následně celý atom.
Závěr: přítomnost α-částic s energiemi řádově 1 MeV a vyššími (takové používali Geiger a Marsden), odražených zpět, vylučuje tak velkou velikost jádra - řádově 0,1 Å.
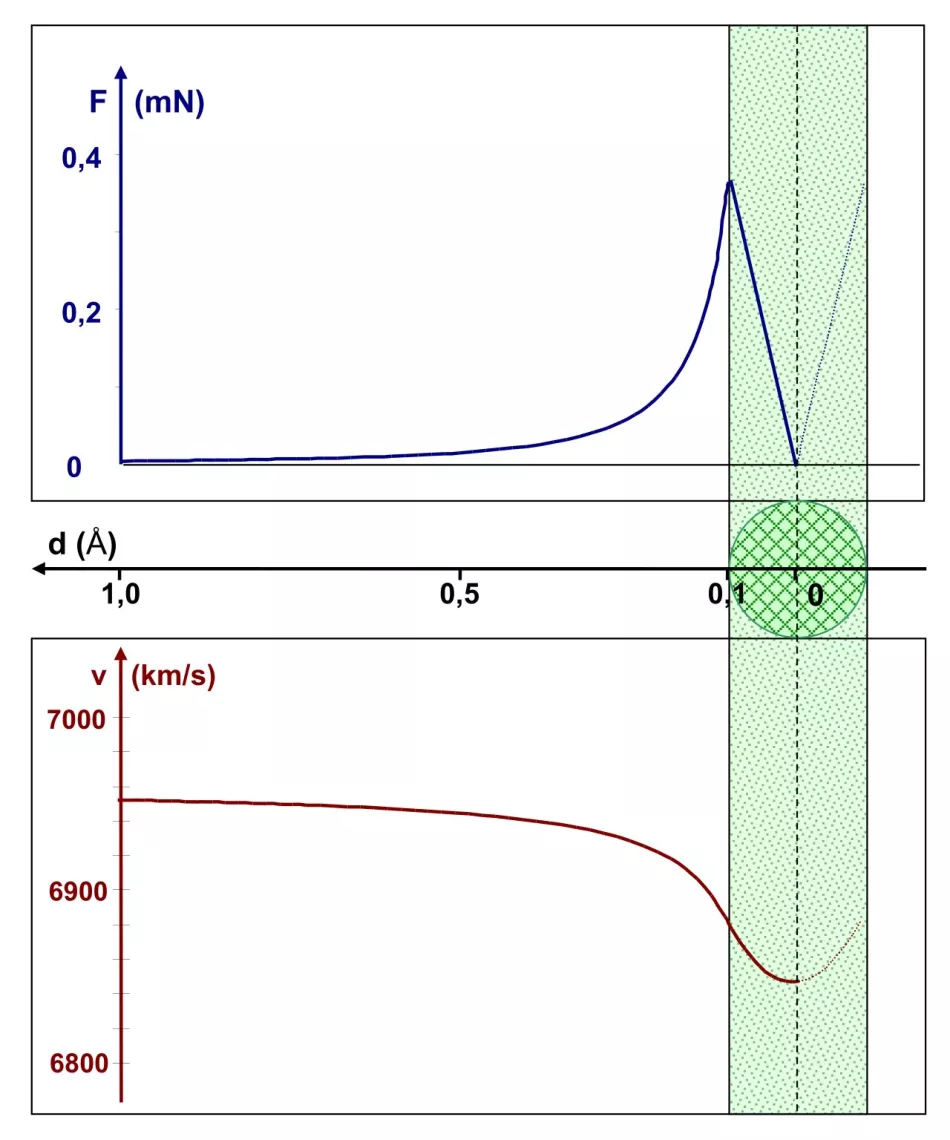 Rýže. 5. Grafy Coulombovy síly a rychlosti částice α jako funkce vzdálenosti d od středu atomového jádra Obr.
Rýže. 5. Grafy Coulombovy síly a rychlosti částice α jako funkce vzdálenosti d od středu atomového jádra Obr.
Vodorovná osa společná pro oba grafy se nachází mezi nimi. Jádro o poloměru 0,1 Å (znázorněno zeleně) se nachází na pravé straně grafu, takže osa vzdálenosti má neobvyklé otočení: doleva.
Rj=0,01 Å, tzn. jádro je 100x menší než atom
Proto v dalším kole výpočtů zmenšíme poloměr jádra desetkrát, na 0,01 Å. Obrázek 6 ukazuje tuto situaci, i když již neobsahuje atom, jehož přibližný poloměr je 1 Á. Všimněte si měřítka na ose vzdálenosti - graf nyní pokrývá oblast od 0,1 Å do středu jádra. Jeho průběh je velmi podobný tomu předchozímu. Rozdíl spočívá v měřítku. Coulombova síla dosahuje na okraji menšího jádra 40 mN, což je stokrát větší než u většího jádra. Je to pochopitelné: poměr poloměrů 1:10 znamená poměr sil 100:1. To vede ke snížení rychlosti částic α asi o 18 %. K nule však neklesá, takže částice alfa projde středem jádra a proletí atomem.
Závěr: atomové jádro musí mít poloměr dokonce menší než 0,01 Å, jinak neodrazí α-částice zpět.
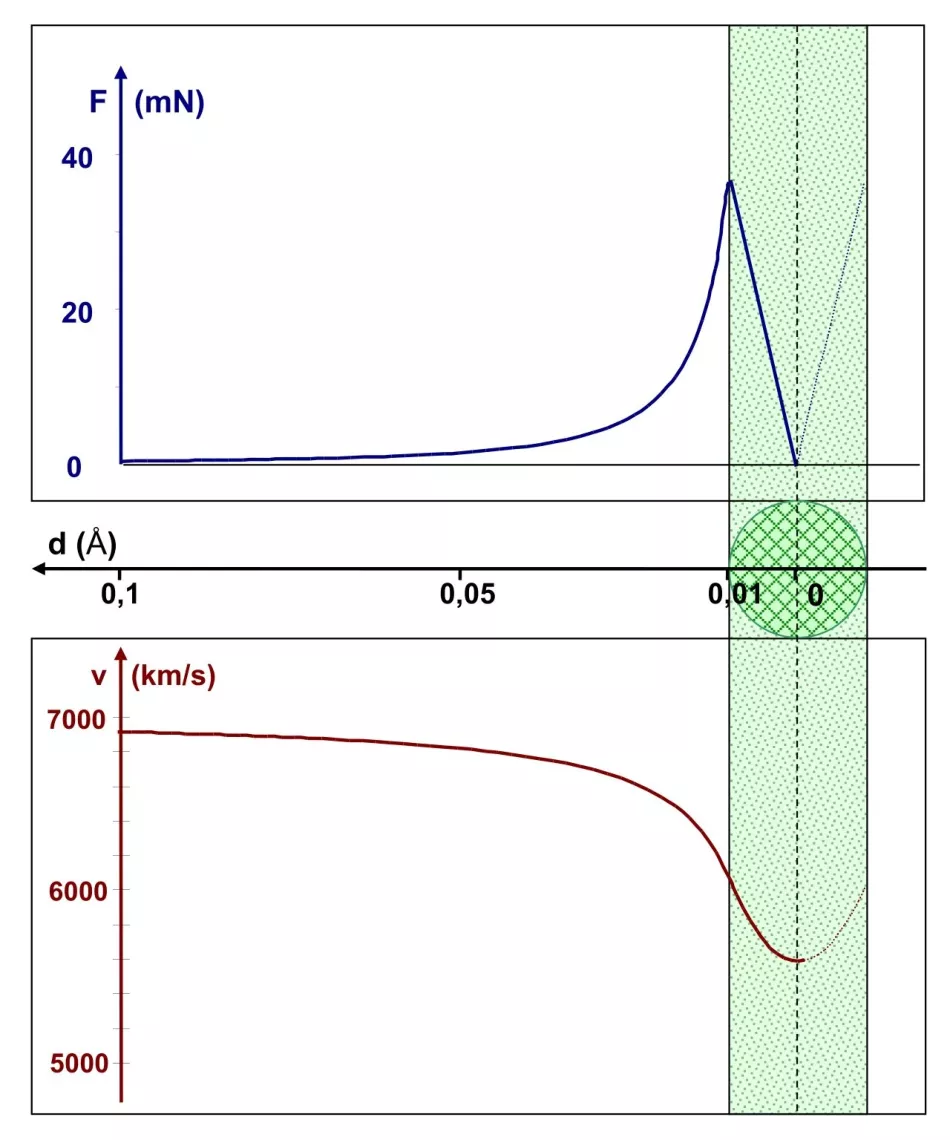 Rýže. 6. Grafy závislosti Coulombovy síly a rychlosti částice α v závislosti na vzdálenosti d od středu atomového jádra o poloměru 0,01 Å Obr.
Rýže. 6. Grafy závislosti Coulombovy síly a rychlosti částice α v závislosti na vzdálenosti d od středu atomového jádra o poloměru 0,01 Å Obr.
Maximální hodnota síly je stokrát větší než v případě znázorněném na obrázku 5, což znamená větší pokles rychlosti částice α.
Rj=0,001 Å, tzn. jádro je 1000krát menší než atom
Zmenšíme ještě jednou poloměr jádra desetkrát – na tisícinu angstromu – beze změny dalších parametrů. V diagramu rychlosti si všimneme (obr. 7.) něčeho nového: jeho hodnota klesne na nulu, když je částice α ve vzdálenosti asi 0,0023 Å od středu jádra, tzn. 0,0013 Å od jeho okraje. V této poloze byla α-částice urychlena ve směru, odkud přišla - její úhel rozptylu je 180°. Stojí za zmínku, že Coulombova síla dosáhla hodnoty asi 700 mN.
Závěr: atomové jádro o poloměru 0,001 Å je schopno zastavit α-částici s energií 1 MeV a rozptýlit ji zpět. Existuje pro to dokonce určitá „marže“, protože částice se zastaví o něco více než 0,001 Å od okraje takového jádra.
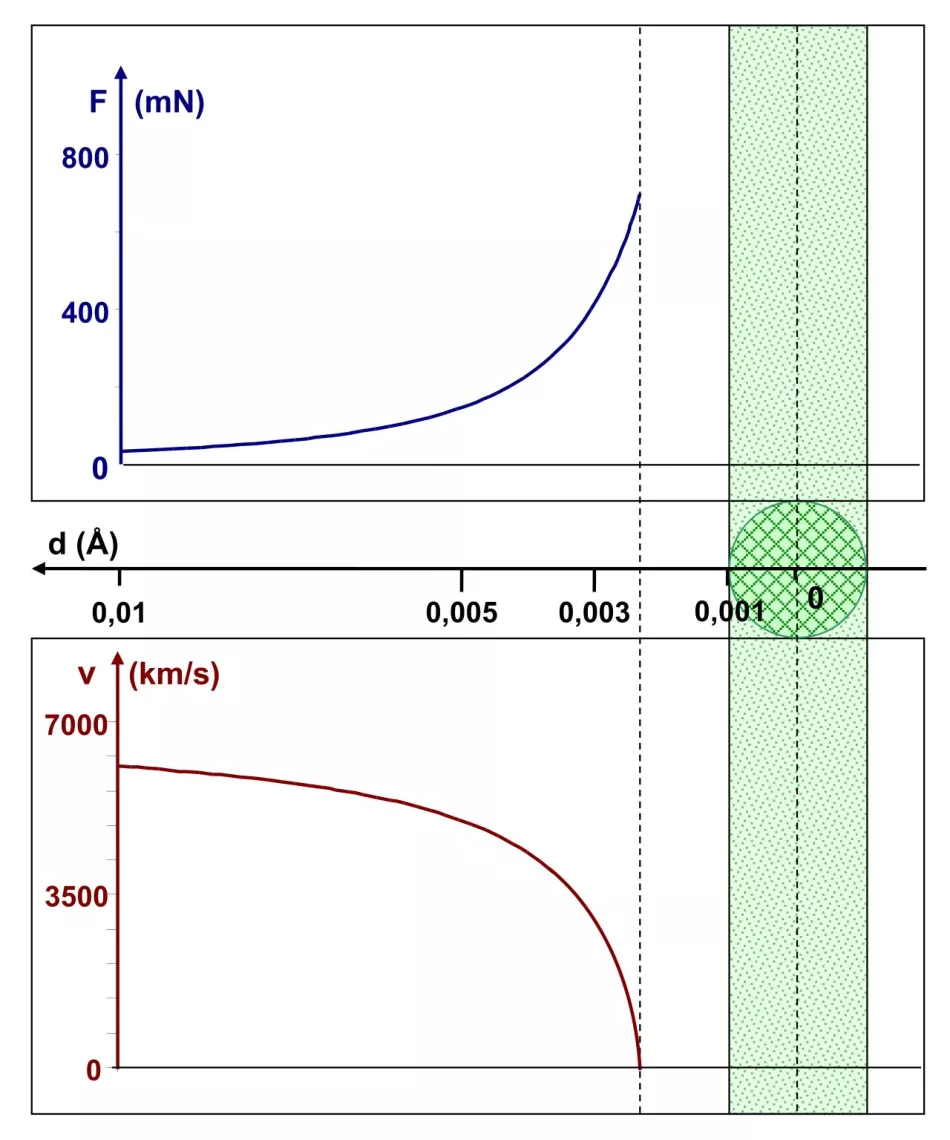 Rýže. 7. Grafy závislosti Coulombovy síly a rychlosti částice α v závislosti na vzdálenosti d od středu atomového jádra o poloměru 0,001 Å Obr.
Rýže. 7. Grafy závislosti Coulombovy síly a rychlosti částice α v závislosti na vzdálenosti d od středu atomového jádra o poloměru 0,001 Å Obr.
Ve vzdálenosti asi 0,0013 Å od okraje se částice alfa zastaví a zrychlí ve směru, odkud přišla.
Závěr
Přítomnost α-částic s energií 1 MeV, rozptýlených zpět, vylučuje poloměr atomového jádra větší než 0,002 Å. Geiger a Marsden produkovali částice alfa s energiemi v rozmezí od 1 MeV do asi 5 MeV z několika různých radioaktivních přípravků. Všichni byli zatlačeni zpět. Podobné úvahy a výpočty umožnily Rutherfordovi určit maximální možný poloměr atomového jádra, který je přibližně 0,001 Å.
Další studie struktury atomu pomocí různých částic, včetně protonů urychlovaných v urychlovačích na stále vyšší energie, umožnily studovat velikosti jader různých atomů. Ukázalo se, že poloměr jádra se zvětšuje s růstem jeho hmotnostního čísla A, ale nedosahuje 0,0001 Å, neboli 10-14 m.
Paralelní studie atomového složení umožnily přibližně čtvrt století po experimentech provedených pod vedením Rutherforda a po objevu neutronu v roce 1932 určit složení atomových jader různé prvky a jejich izotopy.